细胞死亡专题
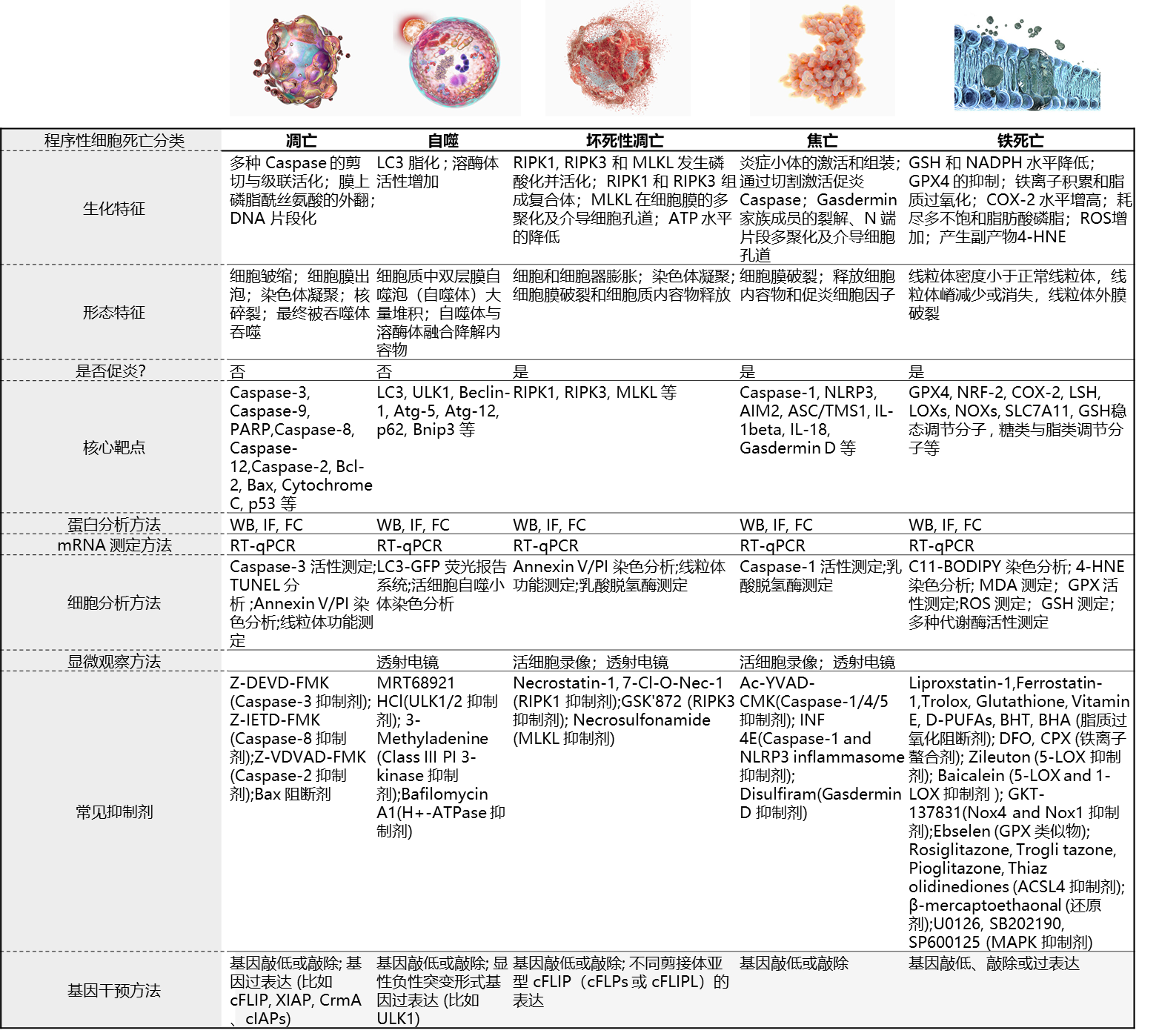
程序性细胞死亡(Programmed Cell Death, PCD)是由细胞内特定基因调控的分子程序介导的的细胞死亡过程,在多细胞生物的正常发育过程和体内稳态维持中发挥至关重要的作用。迄今为止,已经有至少五种主要的PCD被发现和深入研究,包括凋亡(Apoptosis),自噬(Autophagy)或自噬性细胞死亡(Autophagic Cell Death),坏死性凋亡(Necroptosis)、焦亡(Pyroptosis)和近年来逐渐兴起的铁死亡(Ferroptosis)。
不同形式的PCD可以通过其独特的形态、生化和分子特征来区分。并且,不同形式的PCD所涉及的关键基因大多是进化保守的,其中一些效应分子往往作为PCD的特异性评价指标,与形态学和生化检测方法一起用于检测和分析不同PCD过程。为了验证某种PCD是否参与某种病理过程及研究其具体的分子机制,针对关键靶点的多种抑制剂和基因操作策略也被广泛使用。
五种主要PCD(凋亡、自噬、坏死性凋亡、焦亡和铁死亡)的主要特征、关键靶点和研究策略的对比
服务项目
1. 蛋白分析:WB、免疫荧光(IF)、流式细胞术
2. mRNA分析:RT-qPCR
3. 显微观察:活细胞动态成像、透射电镜
4. 基因敲低/敲除或过表达(瞬转、稳转等)
5. 细胞表型及功能分析:
ü Caspase-1活性分析
ü Caspase-3 活性测定
ü TUNEL 分析
ü Annexin V/PI 染色分析;
ü 线粒体功能测定
ü LC3-GFP 荧光报告系统
ü 活细胞自噬小体染色分析
ü 乳酸脱氢酶测定
ü C11-BODIPY 染色分析
ü 4-HNE 染色分析; MDA 测定
ü GPX 活性测定
ü ROS 测定
ü GSH 测定
ü 代谢酶活性测定
典型研究方法1——细胞焦亡(Pyroptosis)
细胞焦亡的机制中GSDMD的切割,IL-1β和IL-18前体的切割成熟和释放是关键信号,因此证明所诱发的细胞死亡方式是否为细胞焦亡,需要几个关键的实验证据:
(1) GSDMD的切割 (Western检测);
(2) Caspase的激活,主要是Caspase-1,Caspase-4,Caspase-5,Caspase-11。(Western检测);
(3) IL-1β和IL-18前体的切割成熟和释放 (Western,ELISA等);
(4)细胞形态学检测(CCK-8等);
(5)染色质完整性检测 (Tunel等)。
完整检测方式如下:
1、形态变化
(1)扫描电镜观察细胞形态;
(2)免疫荧光染色(GSDMD/GSDME);
(3)Tunel检测。
2、检测焦亡相关基因及蛋白
(1)q-PCR/Western Blot方法检测焦亡相关基因或蛋白的表达水平(例如,Caspase-1、4、5、11;GSDMD;Cleaved Caspase-3、IL-1β、IL-18、NLRP3、ASC等);
(2)ELISA试剂盒检测炎症因子的水平;
(3)细胞活力测定(MTT、CCK8等);
(4)免疫组化检测组织蛋白的表达。
典型研究方法2——自噬(Autophagy)
一、自噬研究常用化合物
正常细胞基础水平自噬活性比较低,对自噬研究通常需要进行人工调节和干预,常用药物有:
1、自噬诱导剂
a) Bredeldin A / Thapsigargin / Tunicamycin :模拟内质网应激;
b) Carbamazepine/ L-690,330/ Lithium Chloride(氯化锂):IMPase 抑制剂(即Inositol monophosphatase,肌醇单磷酸酶);
c) Earle's平衡盐溶液:制造饥饿;
d) N-Acetyl-D-sphingosine(C2-ceramide):Class I PI3K Pathway抑制剂;
e) Rapamycin:mTOR抑制剂;
f) Xestospongin B/C:IP3R阻滞剂。
2、自噬抑制剂
a) 自噬抑制剂3-Methyladenine(3-MA):(Class III PI3K) hVps34 抑制剂;
b) Bafilomycin A1:质子泵抑制剂;
c) 溶酶体抑制剂Hydroxychloroquine(羟氯喹)。
二、自噬检测常用方法
1) 透射电镜;
电镜作为自噬检测的金指标。由于自噬体属于亚细胞结构,普通光镜下观察不到自噬体的形成,因此,直接观察自噬体需在透射电镜下。Phagophore的特征为:新月状或杯状,双层或多层膜,有包绕胞浆成分的趋势。自噬体(AV1)的特征为:双层或多层膜的液泡状结构,内含胞浆成分,如线粒体、内质网、核糖体等。自噬溶酶体(AV2)的特征为:单层膜,胞浆成分已降解。
2) WB检测标志物LC3/Atg8、p62/SQSTM1、Lamps、Atg5、Atg14和Beclin-1;
a)利用Western Blot检测LC3-II/I比值的变化以评价自噬形成。自噬形成时,胞浆型LC3(即LC3-I)会酶解掉一小段多肽,转变为(自噬体)膜型(即LC3-II),因此,LC3-II/I比值的大小可估计自噬水平的高低。
b)利用Western Blot检测p62蛋白来评价自噬以及自噬流的强弱:p62蛋白水平的多少与自噬流的强弱有着反比例关系。
3) 组织蛋白酶Cathepsin活力检测;
4) IF检测自噬潮autophagic flux。
三、自噬研究常规思路
通常情况下,除了研究自噬现象本身,大家更多的是将自噬与各种生命活动或者疾病结合起来,把自噬作为这些方向的一个机制来研究。比如研究自噬如何参与肿瘤的发生发展、如何参与肿瘤的耐药性与复发转移、如何参与肿瘤免疫治疗的效果、如何参与炎症反应、如何参与氧化应激,如何参与自闭症、阿尔兹海默症的发生与治疗等,通常的研究模式:
1)证明自噬参与了相关研究表型(电镜、LC3II/I-WB、LC3亚细胞定位、LC3荧光示踪监测自噬流等)
2)证明自噬在表型中起到关键作用(通过自噬抑制剂、激动剂进行关联研究)
3)找到表型与自噬桥梁分子(检测pI3K通路、Beclin-1、ATG家族各成员)
4)在基因层面通过gain of/lost of function研究桥梁分子在自噬中的作用。
典型研究方法3——铁死亡(Ferroptosis)
铁死亡是一种依赖于铁离子的程序性细胞死亡形式,是由于多种因素(如药物或基因因素)造成代谢过程的改变和过氧化脂质的积累,使细胞膜结构受损而引起。铁死亡有一些不同于其他程序性死亡的特殊细胞形态学特征,例如线粒体变小,线粒体膜密度增高,线粒体嵴减少或消失,线粒体外膜破裂。铁死亡与神经退行性疾病(如阿尔茨海默症、亨廷顿氏症和帕金森病)、癌变、中风、脑出血、创伤性脑损伤、心脏缺血再灌注损伤和哺乳动物肾脏变性有关,也与植物的热应激有关。 铁死亡的起始和执行与氨基酸、脂质和铁代谢调节都有联系,受到多种分子机制的调控,大致可分为几类:A)GSH和氧化还原稳态调节相关,如胱氨酸/谷氨酸反向转运体系统、GPX4的调节、硫转移系统、甲羟戊酸(MVA)途径、谷氨酰胺代谢途径、NRF2和p53调节轴;B)铁稳态调节相关,如ATG5-ATGA7-NCOA4铁自噬调节蛋白途径、IREB调节系统、热休克蛋白调节途径;C)糖类和脂类代谢的相关酶,如PHGDH、G6PD、ACSL4和LPCAT3等;D)线粒体功能调节,如VDAC、线粒体电子传递链(ETC)、TCA循环和谷氨酰胺水解;E)最近的研究表明,FSP1-CoQ10-NAD(P)H通路是一个独立的平行系统,与GPX4和GSH协同作用,抑制脂质过氧化和铁死亡。此外,FSP1的表达与数百个肿瘤细胞株中的铁死亡耐药呈正相关,这对于预测铁死亡诱导药物在癌症中的疗效至关重要,并建议潜在的FSP1抑制剂作为克服许多癌症铁死亡耐药的策略。
一、铁死亡的特征
1、超微形态学特征显示细胞膜断裂和出泡,线粒体变小、膜密度增高、线粒体脊减少或消失、线粒体外膜断裂,细胞核大小正常、但缺乏染色质凝聚。电镜下表现为细胞内线粒体变小及双层膜密度增高。
2、生物学特征为铁和活性氧(ROS)聚集,激活丝裂原活化蛋白激酶(mitogen-activatedprotein kinase,MAPK)系统,通过降低胱氨酸的摄取、耗竭谷胱甘肽,抑制 ystem Xc-和增加还原型酰腺嘌呤二核苷酸磷酸氧化酶,释放花生四烯酸等介质。
3、免疫学特征为损伤相关分子模式(damage-associatedmolecular patterns molecules,DAMPs)释放前炎症介质(如高迁移率族蛋白 B1 等)。
4、 基因水平上主要受核糖体蛋白 L8(ribosomalprotein L8,RPL8),铁反应元件结合蛋白(ironresponse element binding protein 2,IREB2),ATP 合成酶 F0 复合体亚基 C3(ATP synthase F0 complex subunit C3,ATP5G3),三四肽重复结构域 35(tetratricopeptide repeat domain 35,TTC35),柠檬酸合成酶(citratesynthase,CS),酰基辅酶 A 合成酶家族成员 2(acyl-CoAsynthetase family member 2,ACSF2)以及受代谢、储存基因 TFRC、ISCU、FTH1、FTL、SLC11A2 的调节。
铁死亡的的本质是细胞内脂质氧化物的代谢障碍,进而在铁离子的催化下异常代谢,产生大量脂质,破坏细胞内氧化还原平衡,攻击生物大分子,触发细胞的死亡。
二、铁死亡的检测方法
1、新陈代谢
(1)细胞活性:CCK-8;
(2)铁水平检测:细胞内可以使用PGSK探针,流式细胞术或共聚焦显微镜检测细胞内铁含量的细胞膜透性染料,结果表明,在铁死亡的细胞中,PGSK的绿色荧光会减弱;或者使用Iron Assay Kit检测细胞、组织中的铁水平;
(3)活性氧水平:细胞内活性氧和脂质活性氧通过流式细胞术使用DCFH-DA(表达上调)或C11-BODIPY 荧光探针检测(在铁死亡细胞中,探针会由红色转化为绿色);
(4)qRT-PCR/WB检测:检测与铁死亡相关的蛋白表达,如PTGS2、NOX1、FTH1、COX2、GPX4、ACSL4等,其中COX2、ACSL4、PTGS2、NOX1在铁死亡细胞中表达上调,GPX4、FTH1在铁死亡细胞中表达下调;
2、形态观察
(1)透射电镜直接观察细胞形态:细胞发生铁死亡时线粒体变小以及线粒体膜密度较大;
(2)线粒体观察:向细胞内转染LifeAct-GFP荧光蛋白,一段时间后用有丝分裂追踪器观察线粒体形态;
(3)线粒体膜电位检测:通过流式细胞仪收集TMRE阳性细胞的比例。
3、常用铁死亡研究常用试剂:
(1)System Xc抑制剂,Erastin 及其类似物 sulfasalazine, glutamate, and sorafenib
(2)GPX4 抑制剂,如RSL3,ML162
(3)FIN56可耗尽GPX4和CoQ10
(4)FINO2可间接抑制GPX4,诱导脂质过氧化